一、藥品不良反應(yīng)監(jiān)測(cè)工作進(jìn)展
2013年,國(guó)家食品藥品監(jiān)督管理總局按照《國(guó)家藥品安全“十二五”規(guī)劃》和《藥品不良反應(yīng)報(bào)告和監(jiān)測(cè)管理辦法》的相關(guān)規(guī)定,組織做好藥品不良反應(yīng)監(jiān)測(cè),相關(guān)工作取得新進(jìn)展。
監(jiān)測(cè)體系進(jìn)一步健全,覆蓋面持續(xù)擴(kuò)大。2013年,基層藥品不良反應(yīng)監(jiān)測(cè)機(jī)構(gòu)建設(shè)得到進(jìn)一步加強(qiáng),藥品不良反應(yīng)報(bào)告縣級(jí)覆蓋率達(dá)到93.8%。全國(guó)每百萬(wàn)人口平均報(bào)告數(shù)量達(dá)到983份,高于世界衛(wèi)生組織的推薦數(shù)量,表明我國(guó)發(fā)現(xiàn)和收集藥品不良反應(yīng)信息的能力大幅增強(qiáng)。
信息化水平進(jìn)一步提升,安全預(yù)警機(jī)制更加成熟。加強(qiáng)監(jiān)測(cè)系統(tǒng)的信息化建設(shè),國(guó)家藥品不良反應(yīng)監(jiān)測(cè)系統(tǒng)功能實(shí)現(xiàn)了實(shí)時(shí)數(shù)據(jù)分析和藥品風(fēng)險(xiǎn)預(yù)警管理,建立了國(guó)家和省兩級(jí)信息共享、高效聯(lián)動(dòng)的不良反應(yīng)/事件預(yù)警機(jī)制,藥品安全緊急事件的發(fā)現(xiàn)和處置能力進(jìn)一步提高。2013年共組織調(diào)查61條預(yù)警信息,實(shí)現(xiàn)了藥品安全事件早發(fā)現(xiàn)、早控制。
分析評(píng)價(jià)能力進(jìn)一步增強(qiáng),風(fēng)險(xiǎn)管理水平得到提高。2013年,重點(diǎn)加強(qiáng)基本藥物、中藥注射劑、生物制品等品種的安全評(píng)價(jià)。針對(duì)監(jiān)測(cè)系統(tǒng)提示的安全性問題,對(duì)細(xì)辛腦注射液、養(yǎng)血生發(fā)膠囊、曲美他嗪、頭孢唑林等近50個(gè)(類)品種進(jìn)行了評(píng)價(jià),并采取了相應(yīng)的風(fēng)險(xiǎn)管理和溝通措施,防控藥品安全風(fēng)險(xiǎn)。啟動(dòng)“定期安全性更新報(bào)告”的評(píng)價(jià)工作,督促指導(dǎo)藥品生產(chǎn)企業(yè)做好產(chǎn)品風(fēng)險(xiǎn)管理工作。
風(fēng)險(xiǎn)溝通渠道進(jìn)一步拓寬,社會(huì)參與度更加廣泛。定期發(fā)布藥品不良反應(yīng)信息通報(bào)、藥物警戒快訊等,提示臨床工作者和公眾關(guān)注用藥安全。加強(qiáng)宣傳培訓(xùn)和風(fēng)險(xiǎn)溝通,及時(shí)回應(yīng)社會(huì)關(guān)注的熱點(diǎn)藥品安全性事件,答疑釋惑,推動(dòng)安全合理用藥意識(shí)和水平提高。強(qiáng)化監(jiān)督檢查,推動(dòng)落實(shí)藥品生產(chǎn)企業(yè)在藥品安全中的主體責(zé)任。完善藥品不良反應(yīng)文獻(xiàn)監(jiān)測(cè)機(jī)制,加大與研究機(jī)構(gòu)、協(xié)會(huì)組織等的合作,藥品安全信息收集渠道不斷豐富。
二、藥品不良反應(yīng)/事件報(bào)告情況
(一)報(bào)告總體情況
2013年全國(guó)藥品不良反應(yīng)監(jiān)測(cè)網(wǎng)絡(luò)收到《藥品不良反應(yīng)/事件報(bào)告表》131.7萬(wàn)份,較2012年增長(zhǎng)了9.0%。其中新的和嚴(yán)重藥品不良反應(yīng)/事件報(bào)告29.1萬(wàn)份,占同期報(bào)告總數(shù)的22.1%。1999年至2013年,全國(guó)藥品不良反應(yīng)監(jiān)測(cè)網(wǎng)絡(luò)累計(jì)收到《藥品不良反應(yīng)/事件報(bào)告表》近660萬(wàn)份。
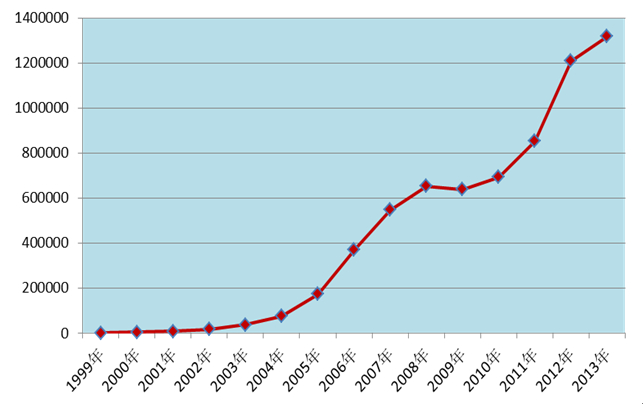
圖1 1999-2013年全國(guó)藥品不良反應(yīng)/事件報(bào)告數(shù)量增長(zhǎng)趨勢(shì)
按報(bào)告涉及患者年齡統(tǒng)計(jì),14歲以下兒童的報(bào)告占10.6%,與2012年基本一致,65歲以上老年人的報(bào)告占17.8%,較2012年升高了1.4個(gè)百分點(diǎn)。
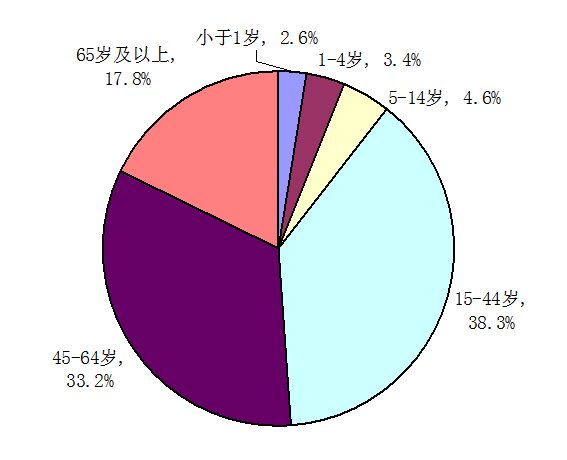
圖2 2013年藥品不良反應(yīng)/事件報(bào)告年齡分布
按報(bào)告來源統(tǒng)計(jì),醫(yī)療機(jī)構(gòu)的報(bào)告占78.4%、藥品經(jīng)營(yíng)企業(yè)的報(bào)告占19.6%、藥品生產(chǎn)企業(yè)的報(bào)告占1.4 %、個(gè)人及其他來源的報(bào)告占0.6%。與2012年相比,藥品生產(chǎn)企業(yè)報(bào)告數(shù)量增長(zhǎng)率最高,但整體報(bào)告數(shù)量仍偏低,經(jīng)營(yíng)企業(yè)報(bào)告數(shù)量略有回落。
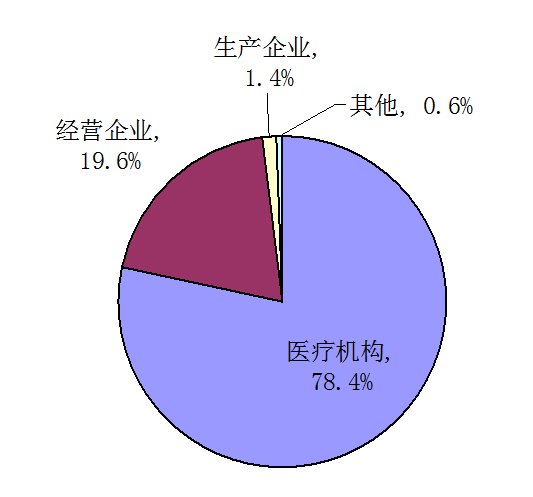
圖3 2013年藥品不良反應(yīng)/事件報(bào)告來源分布
按藥品類別統(tǒng)計(jì),2013年藥品不良反應(yīng)/事件報(bào)告涉及的懷疑藥品,化學(xué)藥占81.3%、中藥占17.3%、生物制品占1.4%。抗感染藥報(bào)告數(shù)量仍居首位,占化學(xué)藥的47.6%,較2012年降低1.2個(gè)百分點(diǎn),報(bào)告比例已連續(xù)4年呈下降趨勢(shì)。心血管系統(tǒng)用藥占化學(xué)藥的10%,較2013年上升0.4個(gè)百分點(diǎn),且連續(xù)4年呈上升趨勢(shì)。
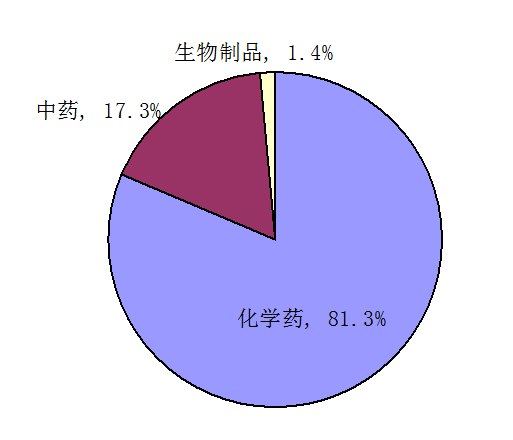
圖4 2013年藥品不良反應(yīng)/事件報(bào)告涉及藥品類別分布
按藥品劑型統(tǒng)計(jì),2013年藥品不良反應(yīng)/事件報(bào)告涉及的藥品劑型分布中,注射劑占58.7%、口服制劑占37.3%、其他制劑占4.0%。注射劑的比例再次出現(xiàn)上升,與2012年相比升高了2個(gè)百分點(diǎn),口服制劑比例降低0.8個(gè)百分點(diǎn)。
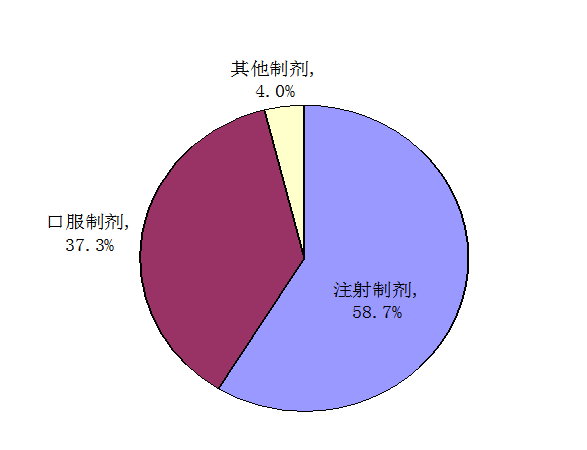
圖5 2013年藥品不良反應(yīng)/事件報(bào)告涉及藥品劑型分布
2013年在醫(yī)療機(jī)構(gòu)、藥品生產(chǎn)企業(yè)、經(jīng)營(yíng)企業(yè)等多方參與和共同努力下,全國(guó)藥品不良反應(yīng)/事件報(bào)告數(shù)量繼續(xù)保持增長(zhǎng)趨勢(shì)(圖1)。其中藥品生產(chǎn)企業(yè)報(bào)告比例已連續(xù)多年呈上升趨勢(shì)(圖6),報(bào)告意識(shí)不斷增強(qiáng)。老年患者的不良反應(yīng)報(bào)告比例有所升高,且已連續(xù)幾年出現(xiàn)增高態(tài)勢(shì),提示應(yīng)關(guān)注老年患者的用藥安全;注射劑的比例在連續(xù)幾年下降或持平后又出現(xiàn)反彈,提示相關(guān)部門應(yīng)建立注射劑風(fēng)險(xiǎn)管理的長(zhǎng)效機(jī)制。2013年在藥品監(jiān)管部門的努力下,報(bào)告質(zhì)量繼續(xù)提高,嚴(yán)重報(bào)告數(shù)量較2012年增加22.5%,嚴(yán)重報(bào)告所占比例(4.3%)較2012年增加了0.5個(gè)百分點(diǎn)。嚴(yán)重不良反應(yīng)/事件為衡量報(bào)告質(zhì)量的重要指標(biāo)之一。
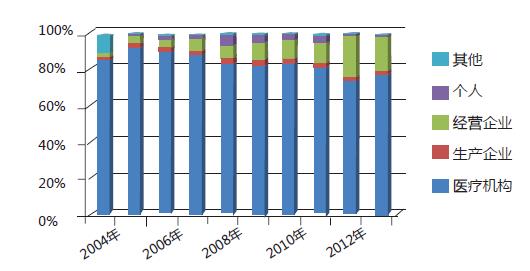
圖6 2004-2013年藥品不良反應(yīng)/事件報(bào)告不同來源比例
(二)抗感染藥監(jiān)測(cè)情況
2013年全國(guó)藥品不良反應(yīng)監(jiān)測(cè)網(wǎng)絡(luò)共收到抗感染藥物的不良反應(yīng)/事件報(bào)告51.7萬(wàn)例,其中嚴(yán)重報(bào)告2萬(wàn)余例,占4.0%。隨著2013年全國(guó)藥品不良反應(yīng)/事件病例報(bào)告數(shù)的整體增長(zhǎng),抗感染藥物的報(bào)告總數(shù)、嚴(yán)重報(bào)告數(shù)較2012年有所升高,分別增長(zhǎng)6.6%和14.3%,增長(zhǎng)率均低于總體報(bào)告的增長(zhǎng)率。
從藥品劑型分析,2013年抗感染藥物不良反應(yīng)/事件報(bào)告中,注射劑占74.3%、口服制劑占23.2%、其他劑型占2.5%。抗感染藥中注射劑比例較總體報(bào)告中注射劑比例高出14.5個(gè)百分點(diǎn)。
2013年抗感染藥物嚴(yán)重報(bào)告中排名前五位的類別是:頭孢菌素類、青霉素類、喹諾酮類、抗結(jié)核病藥和β-內(nèi)酰胺酶抑制藥,與2012年基本一致。嚴(yán)重報(bào)告數(shù)量排名前十位的品種為:頭孢曲松、左氧氟沙星、頭孢哌酮舒巴坦、青霉素G、頭孢呋辛、頭孢噻肟、克林霉素、阿奇霉素、利福平和阿洛西林。
抗感染藥的不良反應(yīng)/事件報(bào)告數(shù)量一直居各類藥物之首,是國(guó)家藥品不良反應(yīng)監(jiān)測(cè)工作關(guān)注的重點(diǎn)。近幾年,抗感染藥的不良反應(yīng)報(bào)告比例出現(xiàn)持續(xù)地小幅下降趨勢(shì),說明我國(guó)對(duì)抗感染藥的風(fēng)險(xiǎn)控制取得一定的實(shí)效。但頭孢類、青霉素類、喹諾酮類藥物,因易導(dǎo)致藥物過敏等不良反應(yīng),加之臨床用量大、不合理用藥因素的影響,不良反應(yīng)報(bào)告數(shù)量居高不下。建議臨床醫(yī)生按照《抗菌藥物臨床應(yīng)用指導(dǎo)原則》,合理使用抗感染藥,加強(qiáng)不良反應(yīng)監(jiān)測(cè)和救治,降低使用風(fēng)險(xiǎn)。
(三)中藥注射劑監(jiān)測(cè)情況
2013年全國(guó)藥品不良反應(yīng)監(jiān)測(cè)網(wǎng)絡(luò)共收到中藥注射劑報(bào)告12.1萬(wàn)例次,其中嚴(yán)重報(bào)告占5.6%。與2012年相比,中藥注射劑報(bào)告數(shù)量增長(zhǎng)17.0%,高于總體報(bào)告增長(zhǎng)率;嚴(yán)重報(bào)告數(shù)量增長(zhǎng)22.3%,與總體嚴(yán)重報(bào)告增長(zhǎng)率基本持平。
2013年中藥注射劑嚴(yán)重不良反應(yīng)/事件報(bào)告前十位的藥品為:清開靈注射劑、參麥注射劑、丹參注射劑、雙黃連注射劑、香丹注射劑、血塞通注射劑、脈絡(luò)寧注射劑、舒血寧注射劑、生脈注射劑和黃芪注射液。
總體上看,2013年中藥注射劑安全狀況平穩(wěn)。中藥注射劑與其他藥品聯(lián)合使用現(xiàn)象依然存在,可能增加安全風(fēng)險(xiǎn),臨床應(yīng)謹(jǐn)慎使用。部分中藥注射劑涉及的基層醫(yī)療衛(wèi)生機(jī)構(gòu)報(bào)告數(shù)量比例較大,提示基層使用此類藥品可能存在較高風(fēng)險(xiǎn)。
(四)基本藥物監(jiān)測(cè)情況
2013年全國(guó)藥品不良反應(yīng)監(jiān)測(cè)網(wǎng)絡(luò)共收到國(guó)家基本藥物的不良反應(yīng)/事件報(bào)告53.0萬(wàn)例,其中嚴(yán)重報(bào)告2.6萬(wàn)例,占4.9%。
國(guó)家基本藥物不良反應(yīng)/事件報(bào)告中,化學(xué)藥品和生物制品報(bào)告數(shù)量排名前五位的均為抗微生物藥,分別是左氧氟沙星、頭孢曲松、頭孢呋辛、青霉素和頭孢唑林。中成藥注射劑排名前五位的品種分別是:清開靈注射液、參麥注射液、血塞通注射液、注射用血塞通(凍干)和丹參注射液;中成藥口服制劑排名前五位的品種分別是:鼻炎康片、雙黃連合劑(口服液、顆粒、膠囊、片)、復(fù)方丹參片(顆粒、膠囊、滴丸)、六味地黃丸(顆粒、膠囊)和黃連上清丸(顆粒、膠囊、片)。
配合《國(guó)家基本藥物目錄》(2012年版)的發(fā)布實(shí)施,國(guó)家食品藥品監(jiān)督管理總局調(diào)整了基本藥物不良反應(yīng)監(jiān)測(cè)平臺(tái),開展了對(duì)新目錄品種的監(jiān)測(cè)工作,并加大對(duì)基本藥物的預(yù)警監(jiān)測(cè)力度。總體上看,2013年國(guó)家基本藥物安全狀況繼續(xù)保持平穩(wěn)態(tài)勢(shì)。
三、用藥安全提示
(一)老年患者不良反應(yīng)報(bào)告比例逐年上升,應(yīng)關(guān)注老年人用藥安全
2009至2013年藥品不良反應(yīng)/事件報(bào)告的年齡分布顯示,65歲以上老年患者的不良反應(yīng)報(bào)告比例已連續(xù)4年呈現(xiàn)小幅升高態(tài)勢(shì)(圖7)。一些藥品的嚴(yán)重不良反應(yīng)報(bào)告中,老年患者所占比例較大。例如治療痛風(fēng)藥別嘌醇片,65歲以上老年患者占嚴(yán)重病例報(bào)告總?cè)巳旱?5.1%。
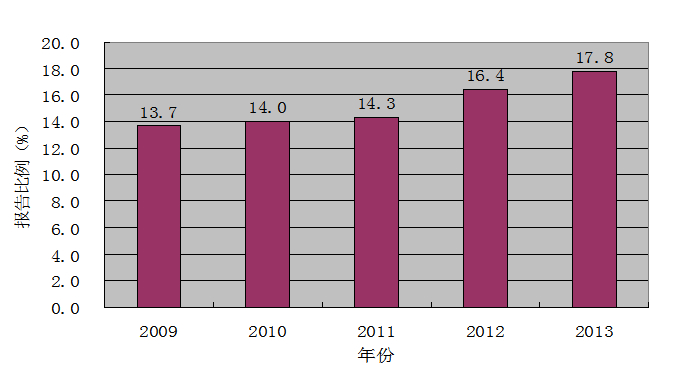
圖7 2009-2013年65歲以上老年患者不良反應(yīng)報(bào)告比率
老年人在生理、心理方面均處于衰退狀態(tài),給用藥安全帶來隱患。在生理方面,老年人肝腎功能退化,藥物吸收、分布、代謝和排泄均受影響,不良反應(yīng)發(fā)生率升高;老年人往往身患數(shù)病,經(jīng)常多種藥物同時(shí)使用,容易發(fā)生藥物相互作用。在心理方面,老年患者安全用藥常識(shí)相對(duì)缺乏,自我風(fēng)險(xiǎn)管理能力較弱;很多老年患者求醫(yī)心切、用藥依從性較差,容易出現(xiàn)不合理用藥情況。
我國(guó)已步入人口老齡化社會(huì),老年人用藥安全問題日益突出,需要社會(huì)各界關(guān)心、關(guān)注老年人健康,共同努力減少藥物損害、藥源性疾病給老年人帶來的健康威脅。
| 小貼士:老年患者如何合理使用抗菌藥? 抗菌藥物在人體吸收以后,多由肝腎解毒、排泄,因此,肝腎功能不全的老年人在使用抗菌藥時(shí)需慎重,不宜長(zhǎng)期或大劑量應(yīng)用。四環(huán)素類抗生素和磺胺類藥物長(zhǎng)期服用會(huì)損害肝細(xì)胞,并伴有對(duì)骨髓、心臟、腎臟及皮膚的損害。鏈霉素、卡那霉素、慶大霉素使用時(shí)間稍長(zhǎng),能引起眩暈、耳鳴、耳聾、平衡失調(diào),對(duì)腎臟也有影響。使用氯霉素可能引起再生障礙性貧血。紅霉素、呋喃妥因等可能在肝膽內(nèi)瘀積,產(chǎn)生中毒和過敏反應(yīng)。 |
(二)中藥注射劑合并用藥現(xiàn)象突出,應(yīng)警惕藥物的相互作用
合并用藥可能引起藥物的相互作用。國(guó)家食品藥品監(jiān)督管理總局發(fā)布的《2011年國(guó)家藥品不良反應(yīng)監(jiān)測(cè)年度報(bào)告》己對(duì)中藥注射劑合并用藥現(xiàn)象進(jìn)行過分析,提醒合并用藥可能會(huì)加大中藥注射劑的安全風(fēng)險(xiǎn)。但就2013年中藥注射劑不良反應(yīng)報(bào)告數(shù)據(jù)分析來看,合并用藥現(xiàn)象并未得到有效緩解。
通過對(duì)2013 年中藥注射劑不良反應(yīng)/事件報(bào)告數(shù)量排名前20 位的藥品合并用藥情況進(jìn)行分析,其總體報(bào)告涉及合并用藥的占41.0%,嚴(yán)重報(bào)告涉及合并用藥的占54.1%。
建議臨床醫(yī)生根據(jù)《中藥注射劑臨床使用基本原則》的要求,單獨(dú)使用中藥注射劑,禁忌與其他藥品配伍使用,謹(jǐn)慎聯(lián)合用藥,如確需聯(lián)合使用其他藥品,應(yīng)考慮與中藥注射劑的間隔時(shí)間以及相互作用等問題。
| 小貼士:什么是藥物相互作用,哪些藥物容易出現(xiàn)相互作用? 藥物相互作用是指兩種或多種藥物合用或先后序貫給藥而引起的藥物作用和效應(yīng)的變化。如阿司匹林與氯吡格雷聯(lián)用可增加出血的風(fēng)險(xiǎn);克拉霉素與地高辛合用,可引起地高辛中毒。治療窗范圍窄的藥物(即劑量稍有變化藥理作用即有明顯改變的藥物)、需要監(jiān)測(cè)血藥濃度的藥物、酶誘導(dǎo)劑和酶抑制劑都容易發(fā)生藥物相互作用,包括口服抗凝藥、口服降糖藥、抗生素類、抗癲癇藥、抗心律失常藥、強(qiáng)心苷和抗過敏藥等。 |
(三)不合理用藥增加藥品安全風(fēng)險(xiǎn),醫(yī)務(wù)人員和患者應(yīng)加強(qiáng)安全用藥意識(shí)
2013年藥品不良反應(yīng)/事件報(bào)告顯示,不合理用藥現(xiàn)象仍然突出。以尼美舒利為例,因其嚴(yán)重肝損害風(fēng)險(xiǎn),2011年5月原國(guó)家食品藥品監(jiān)督管理局發(fā)布通知,規(guī)定尼美舒利禁用于12歲以下兒童,適應(yīng)癥限制在抗炎、鎮(zhèn)痛的二線治療,且療程不超過15天。但尼美舒利的不良反應(yīng)監(jiān)測(cè)數(shù)據(jù)分析顯示,12歲以下兒童的報(bào)告仍占9.8%,用于感冒、發(fā)熱類疾病的報(bào)告占35%,治療時(shí)間超過15天的報(bào)告占1.4%。
不合理使用藥物,不僅可影響藥物的治療作用,更會(huì)加大藥物的使用風(fēng)險(xiǎn)。建議醫(yī)務(wù)人員和患者加強(qiáng)安全用藥意識(shí),掌握必要的安全用藥知識(shí),避免超適應(yīng)癥、超劑量、超療程用藥,嚴(yán)禁禁忌證用藥,謹(jǐn)慎聯(lián)合用藥,防止發(fā)生藥物相互作用。藥品的已知不良反應(yīng)、安全性信息、使用注意事項(xiàng)均記錄在藥品說明書中,建議患者用藥前認(rèn)真閱讀,按說明書規(guī)定用藥,必要時(shí)與醫(yī)生溝通,為自身健康負(fù)責(zé),把好用藥關(guān)。
| 小貼士:如何正確閱讀藥品說明書? 藥品說明書包含了對(duì)藥品各方面的介紹,患者服用前應(yīng)該認(rèn)真地閱讀,按照說明書規(guī)定用藥。有關(guān)藥品使用方面,應(yīng)認(rèn)真閱讀說明書中的【適應(yīng)癥】或【功能主治】、【禁忌】、【用法用量】、【注意事項(xiàng)】;有關(guān)藥品的安全性方面,應(yīng)閱讀警示語(yǔ)(位于說明書最上方)、【不良反應(yīng)】、【藥物相互作用】等。老年人如需調(diào)整用藥劑量,會(huì)在【注意事項(xiàng)】或【老年人用藥】部分進(jìn)行提示,兒童用藥的安全性、孕婦或哺乳期婦女用藥會(huì)對(duì)胎兒或嬰兒產(chǎn)生的影響,會(huì)在【兒童用藥】、【妊娠及哺乳期婦女用藥】部分進(jìn)行提示。為防止相同成份疊加使用導(dǎo)致藥物過量,還應(yīng)詳細(xì)了解說明書中藥品的【成份】,因?yàn)椴煌Q的藥品可能含有相同藥物成份。藥品說明書中的不良反應(yīng)均為臨床研究或上市后監(jiān)測(cè)發(fā)現(xiàn)的已知不良反應(yīng),一些罕見的、新的不良反應(yīng)不一定會(huì)記錄在說明書中,因此患者如果出現(xiàn)疑似不良反應(yīng)癥狀,應(yīng)及時(shí)去醫(yī)院就診。 |
四、相關(guān)風(fēng)險(xiǎn)控制措施
根據(jù)2013年藥品不良反應(yīng)監(jiān)測(cè)數(shù)據(jù)和評(píng)估結(jié)果,國(guó)家食品藥品監(jiān)督管理總局對(duì)發(fā)現(xiàn)存在安全隱患的藥品及時(shí)采取相應(yīng)管理措施,以保障公眾用藥安全。
(一)發(fā)布《藥品不良反應(yīng)信息通報(bào)》7期,通報(bào)了碘普羅胺注射液、紅花注射液、珍菊降壓片、別嘌醇片、氟喹諾酮類藥品、復(fù)方青黛丸(膠丸、膠囊、片)、質(zhì)子泵抑制劑和左氧氟沙星注射劑等的嚴(yán)重不良反應(yīng),對(duì)用藥安全風(fēng)險(xiǎn)進(jìn)行提示。
(二)發(fā)布《藥物警戒快訊》12期,報(bào)道了卡馬西平嚴(yán)重皮膚反應(yīng)、托伐普坦肝損害和他汀類降脂藥血糖異常等國(guó)外藥品安全信息70條。
(三)根據(jù)監(jiān)測(cè)評(píng)價(jià)結(jié)果,發(fā)布了甲磺酸瑞波西汀制劑、西酞普蘭制劑、珍菊降壓片和黃芪注射液等22個(gè)(類)藥品的修訂說明書通知。
(四)基于對(duì)藥品效益和風(fēng)險(xiǎn)的全面評(píng)估,停止了丁咯地爾、甲丙氨酯制劑的生產(chǎn)、銷售和使用,并撤銷批準(zhǔn)證明文件。
(五)針對(duì)監(jiān)測(cè)中發(fā)現(xiàn)的風(fēng)險(xiǎn)信號(hào),實(shí)施企業(yè)約談機(jī)制,組織召開企業(yè)溝通會(huì),要求企業(yè)開展相關(guān)風(fēng)險(xiǎn)管理工作。對(duì)監(jiān)測(cè)中發(fā)現(xiàn)存在安全隱患的藥品,督促企業(yè)查找原因、及時(shí)整改,可能造成嚴(yán)重影響及不良后果的,要求企業(yè)主動(dòng)召回產(chǎn)品。
五、有關(guān)說明
(一)本年度報(bào)告中的數(shù)據(jù)來源于國(guó)家藥品不良反應(yīng)監(jiān)測(cè)網(wǎng)絡(luò)中2013年1月1日至2013年12月31日各地區(qū)上報(bào)的數(shù)據(jù)。
(二)與大多數(shù)國(guó)家一樣,我國(guó)藥品不良反應(yīng)監(jiān)測(cè)網(wǎng)絡(luò)收集的數(shù)據(jù)存在局限性,如漏報(bào)、填寫不規(guī)范、缺乏詳細(xì)信息、無法計(jì)算不良反應(yīng)發(fā)生率等。
(三)本年度報(bào)告完成時(shí),其中一些嚴(yán)重報(bào)告、死亡報(bào)告尚在調(diào)查和評(píng)價(jià)的過程中,所有統(tǒng)計(jì)結(jié)果均為數(shù)據(jù)收集情況的真實(shí)反映,有些問題并不代表最終的評(píng)價(jià)結(jié)果。
(四)每種藥品不良反應(yīng)/事件報(bào)告的數(shù)量受到該藥品的使用量和該藥品不良反應(yīng)發(fā)生率等諸多因素的影響,故藥品不良反應(yīng)/事件報(bào)告數(shù)量的排名僅是報(bào)告數(shù)據(jù)多少的直接反映,不代表不良反應(yīng)發(fā)生率的高低。
(五)本年度報(bào)告不包含疫苗不良反應(yīng)/事件的監(jiān)測(cè)數(shù)據(jù)。
| 小貼士:美國(guó)、歐洲國(guó)家如何發(fā)布藥品不良反應(yīng)信息? 美國(guó)食品藥品管理局(FDA)和歐洲藥品監(jiān)管部門如果在上市后藥品監(jiān)測(cè)、研究過程中發(fā)現(xiàn)了新的或嚴(yán)重的藥品不良反應(yīng),會(huì)組織本部門或外部專家,對(duì)藥品的各類相關(guān)資料進(jìn)行審查,開展評(píng)估工作。對(duì)認(rèn)為可能影響公眾用藥安全的問題,將在其網(wǎng)站、刊物或通過其他途徑發(fā)布相關(guān)安全性信息,同時(shí)要求企業(yè)面向醫(yī)務(wù)人員和患者溝通信息,美國(guó)、歐洲國(guó)家發(fā)布不良反應(yīng)信息的過程與我國(guó)基本一致。我國(guó)藥品不良反應(yīng)監(jiān)測(cè)中心對(duì)這些信息實(shí)施24小時(shí)監(jiān)測(cè),必要時(shí)對(duì)藥品開展評(píng)價(jià)工作,并提出符合我國(guó)國(guó)情的監(jiān)管措施。 |








